Table of Contents
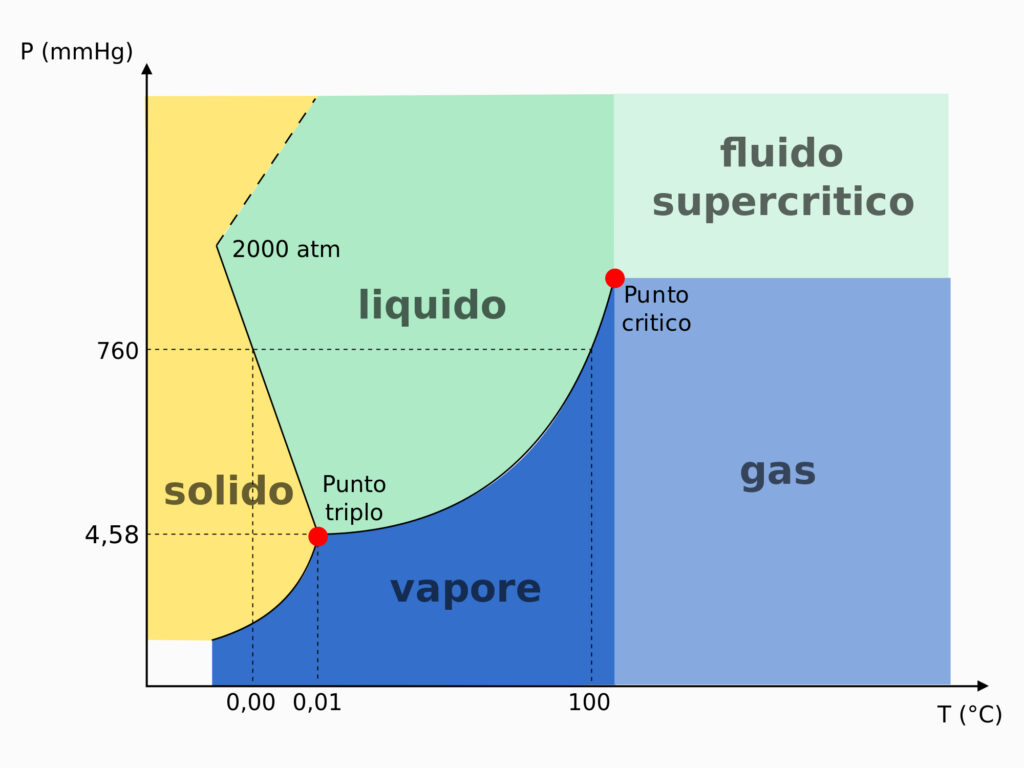
Questa immagine (diagramma), è chiamato anche diagramma di fase. In particolare, è il diagramma di fase dell'acqua, un liquido a noi molto noto e con caratteristiche molto particolari. Indica il passaggio da solido, liquido, vapore, gas, in funzione della temperatura e della pressione.
Come si legge?
Sull'asse orizzontale avete la temperatura che aumenta verso destra.
Sull'asse verticale avete la pressione che aumenta verso sinistra.
Nel grafico, 760 mmHg è la pressione ambiente (1 atm = 1 atmosfera). Se rimanete sulla linea orizzontale dei 760 e vi spostate in orizzontale, state facendo variare la temperatura. Le separazioni tra le varie aree indicano a quale temperatura l'acqua passa da uno stato a un altro.
A 760 mmHg:
0°C fusione (confine liquido-solido)
100°C ebollizione (confine (liquido-vapore)
Se provate a tracciare una linea orizzontale a una pressione più bassa:
vi accorgerete che la temperatura di fusione sale e la temperatura di ebollizione scende.
Sapevate che?
Al diminuire della temperatura, l'acqua diminuisce di volume, fino a 4°C, mentre da 4°C a 0°C, aumenta di volume.
Questo fenomeno è tipico dell'acqua. Fa si, ad esempio, che nei laghi e nei fiumi, sia la superficie a congelare, mentre l'acqua a 4°C, relativamente più calda, si deposita sul fondo. Questo fenomeno permette ai pesci di continuare a nuotare liberamente sul fondale, senza rimanere intrappolati nel ghiaccio.
Differenza tra vapore e gas
Sono entrambi aeriformi, ma la loro distinzione dipende dal loro diagramma di stato. Se, a temperatura ambiente (25°C), aumentando la pressione:
a) è possibile passare allo stato liquido, allora si parla di vapore.
b) non è possibile passare allo stato liquido, allora si parla di gas.